
Schießpulver
Als Treibmittel für konventionelle militärische Waffen wird seit langem ausschließlich rauchloses, richtiger rauchschwaches Pulver verwendet.

Der 4V-Verlag Hamburg
Als Treibmittel für konventionelle militärische Waffen wird seit langem ausschließlich rauchloses, richtiger rauchschwaches Pulver verwendet. Unterschieden werden einbasige Pulver wie Nitrocellulosepulver, zweibasige Pulver aus Nitrocellulose und Nitroglycerin und dreibasige Pulver wie Nitrocellulose und Nitroglycerin oder Nitrocellulose und Diglykoldinitrat plus Nitroguanidinpulver.
Nitrocellulose ist ein Nitratester der Cellulose. Sie entsteht durch Einwirken von Nitriersäure (Salpetersäure und Schwefelsäure) auf Baumwolle oder Holzzellstoff. Nach der vollständigen Nitrierung lautet die Bruttoformel C6H7O2(ONO2)3. Grundbestandteil der Nitrocellulosepulver ist Nitrocellulose, ein Gemisch aus Schießbaumwolle (Stickstoffgehalt von 13,26 bis 13,35 %) und Collodiumwolle (Stickstoffgehalt von 11 bis 13 %).
Zur Pulverherstellung wird das Nitrocellulosegemisch mit Hilfe von Lösungsmitteln, meist Alkohol und Äther, gelatiniert. Weitere Zusätze wie Stabilisatoren werden jetzt zugegeben. Die so erhaltene plastische und lösemittelfeuchte Masse wird durch hydraulische Strangpressen in Streifen-, Nudel- oder Röhrenform gepreßt und mit Schneidemaschinen auf die gewünschte Länge geschnitten. Die im Pulver noch vor handenen Lösemittel werden durch Wässern und Trocknen des Pulvers entfernt. Nach dem Trocknen wird das Pulver in Trommeln poliert und graphitiert. Dabei wird gleichzeitig seine Oberfläche mit alkoholischen Lösungen von Centralit, Dibutylphthalat, Campher, Dinitrotoluol oder anderen phlegmatisierenden Stoffen behandelt.
Zur Herstellung von Nitroglycerinpulver wird Nitrocellulose in Wasser aufgeschwemmt, das Nitroglycerin der intensiv aufgerührten Suspension langsam zugegeben, wobei das Nitroglycerin von der Nitrocellulose praktisch völlig gebunden wird. Dann wird der größte Teil des Wassers (bis auf 25 bis 35 %) abzentrifugiert oder abgepreßt und die Pulverrohmasse zerkleinert. Anschließend wird sie, falls erforderlich, zusammen mit den Zusätzen, die nicht in Nitroglycerin löslich sind, in Mischwerken vermengt und dann auf geheizten Walzwerken gelatiniert, wobei das Wasser bis auf einen Rest von ca. 1 % verdampft.
Diesem in der Wärme plastischen Produkt wird dann, je nach Pulvertyp, auf Kaliberwalzen, Schneidemaschinen, Stanzen oder auch durch hydraulische Strangpressen die endgültige geometrische Form gegeben, die das Abbrandverhalten bestimmt.
Dieses ohne Lösungsmittel hergestellte „POL-Pulver“ hat gegenüber Nitrocellulosepulver den Vorteil größerer Gleichmäßigkeit, denn größere Schwankungen, die durch zurückgehaltene Lösemittelreste entstehen, werden vermieden. Ein weiterer Vorteil ist seine kürzere Fertigungszeit infolge Fortfalls der Trockenzeiten. Die Nitroglycerinpulver werden, je nach Verwendungszweck, mit einem Nitroglyceringehalt von 25 bis 50 % gefertigt.
In USA und England werden heute noch viele Nitroglycerinpulver und Nitroguanidinpulver mit Hilfe von Lösungsmitteln hergestellt. Zur Erleichterung des Knet- und Preßvorganges wird dem Nitroglycerin zunächst Aceton zugefügt, das später durch Trocknen wieder entfernt werden muß.
In neuerer Zeit hat man anstelle des Nitroglycerins eine Reihe anderer flüssiger Salpetersäureester eingeführt (Diglykoldinitrat, Triglykoldinitrat, Methrioltrinitrat, Butantrioltrinitrat), von denen das Diglykoldinitratt größere Verwendung gefunden hat. Mit ihm oder mit Triglykoldinitrat werden kalorienärmere Pulver erzeugt; für die Rohrlebensdauer besonders der großen Geschütze ist dies besonders wichtig. Die “kalten” rohrschonenden Pulver wurden bereits während des II. Weltkrieges in Deutschland entwickelt.
Die weitere Entwicklung zur Fertigung von rohrschonenden Pulvern mit noch günstigeren Eigenschaften ergab das „kalte Nitroguanidinpulver“, bei dem als Energieträger zu Diglykoldinitrat (oder Triglykoldinitrat) und Nitrocellulose als dritte Komponente Nitroguanidin hinzutritt (triple base powder).
Der Nitroguanidingehalt beträgt 25 bis 40 %, die Pulver werden analog der POL-Fertigung, also ohne Lösungsmittel, hergestellt. Pulver mit einem Anteil von über 40% Nitroguanidin können nur mit Hilfe von Lösemitteln hergestellt werden. Die Nitroguanidinpulver bieten bei konventionellen Waffen weltweit die günstigste Lösung zur Schonung der Rohre.
Offiziell arbeitet man seit etwa 1970 auch an der Entwicklung nitratesterfreier LOVA-Treibladungspulver. Diese Treibmittel sind unempfindlicher gegenüber thermischen und mechanischen Einwirkungen als Nitrocellulosepulver. Sie können zu Geschoßträgern geformt werden und bilden so die Grundlage der modernen hülsenlosen Munition.
Die im I. Weltkrieg gemachten Erfahrungen mit Ammonpulver führten dazu, die Verwendung von Ammonnitrat als Bestandteil der üblichen POL-, Nitroglycerin- bzw. Diglykolpulver zu überprüfen. Die Erfahrungen waren aber schlecht, da durch die Hygroskopizität des Ammonnitrats Schwierigkeiten bei seiner Verarbeitung auftreten, so daß diese Pulvertypen bei den konventionellen Feuerwaffen nur äußerst zurückhaltende Verwendung gefunden haben.
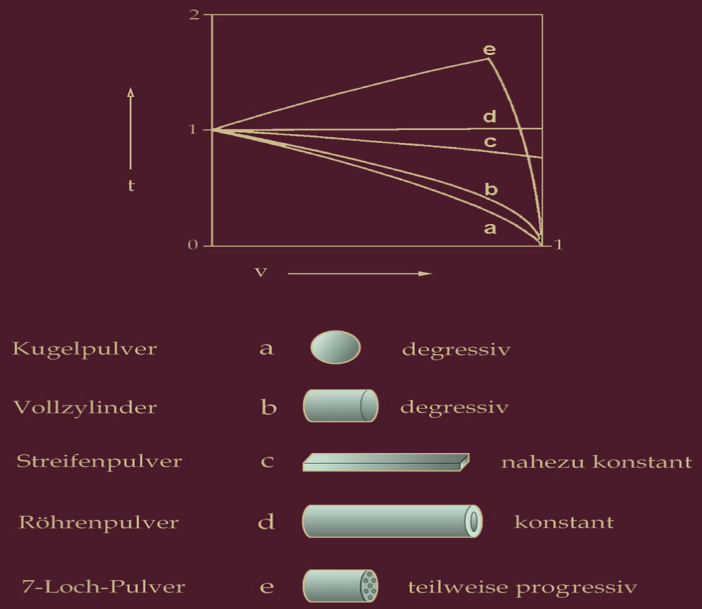
Die ballistischen Eigenschaften des Pulvers werden außer durch die chemische Zusammensetzung auch durch die Formgebung beeinflußt. Für konventionelle Waffen wird grundsätzlich ein progressiver Abbrand, zumindest aber ein Pulverkorn mit während des Abbrandes konstanter Oberfläche, angestrebt.
Man unterscheidet je nach der geometrischen Form folgende Pulvertypen:
– Röhrenpulver (lange Röhren)
– Röhrchenpulver (kurz geschnittene Röhren)
– Mehrlochpulver (kurze Röhren, mehrfach perforiert)
– Blättchenpulver
– Streifenpulver
– Kugelpulver
– Würfelpulver
– Nudelpulver (kurz geschnittene Stäbchen)
– Ringpulver.
Für Handfeuerwaffen werden die feinkörnigen Pulver, für Kanonen in erster Linie Röhrenpulver, für Steilfeuergeschütze (Haubitzen, Mörser) vorteilhaft Blättchen- und
Röhrchenpulver verwendet.
Der Pulverabbrand
Die Umsetzung des Pulvers erfolgt an der Oberfläche des einzelnen Korns mit einer Umsetzungsrate der oberflächennahen Schicht (lineare Verbrennungsgeschwindigkeit), die im wesentlichen von der chemischen Zusammensetzung des Pulvers und dem Druck in der Gasphase abhängt. Der Anteil der Treibladung, der in der Zeiteinheit umgesetzt wird, hängt von der linearen Brenngeschwindigkeit und der Geometrie des Pulvers ab. Diese lineare Brenngeschwindigkeit ist die Geschwindigkeit, mit der die chemische Umsetzung von der Anzündstelle infolge Wärmeleitung und -strahlung fortschreitet. Die Schwaden strömen entgegengesetzt zur Fortschreitungsrichtung ab. Die Abbrandgeschwindigkeit bezeichnet den Abbrandfortschritt im Treibmittel; sie ist nicht nur von der Zusammensetzung, dem Druck, der Temperatur, dem physikalischen Zustand des Treibmittels (Porosität, Korngrößenverteilung der Bestandteile, Verdichtung) abhängig, sondern auch von der Formgebung, also von der Größe der Pulverelemente und ihrer Form als Blättchen, Kugeln, Röhren, Mehrlochröhrchen usw. bis zu den kompliziertesten Formen der Raketentreibsätze. In der Raketentechnik bezeichnet der Begriff der Abbrandgeschwindigkeit den stationären Abbrandfortschritt in der Brennkammer. Im geschlossenen Raum wächst der Druck P bis zum Erreichen seines Maximalwertes Pmax. In der Waffe sinkt der Druck nach einem Maximalwert wieder ab, da sich durch die Geschoßbewegung im Rohr der Verbrennungsraum stetig vergrößert. Bei kontinuierlichem Abströmen der Schwaden, wie z.B. bei einer Rakete, bleibt der Druck während des Abbrandes konstant. Die lineare Brenngeschwindigkeit (burningrate) und ihre Abhängigkeit von Druck und Temperatur kann nur experimentiell bestimmt werden (Crawford-Bombe).
Die nachfolgende Zeichnung vom Brennverhalten der Pulverformen läßt erkennen, daß Röhrenpulver (d) mit konstanter Formfunktion abbrennt, denn die Abnahme der
äußeren Oberfläche der Röhre wird durch die Zunahme der Oberfläche der Bohrung aufgehoben. Dabei ist vorgegeben, daß die Pulverröhre wesentlich länger ist als ihr Durchmesser. Das Streifenpulver c verhält sich genauso, wenn Breite und Länge des Streifens groß genug gegenüber seiner Dicke sind. Dieser Zustand ist erreicht, wenn Dicke und
Breite des Streifens weniger als ein Vierter der Länge betragen. Kugel- und Würfel oder Blättchenpulver a und Pulver in der Form von Vollzylindern b zeigen einen stark degressiven Verlauf der Formfunktion, während beim 7-Loch-Pulver e die Oberfläche zunächst zunimmt bis zu dem Punkt, an dem die einzelnen Stege des Pulverkorns abgebrannt sind. Dann nimmt auch die Oberfläche des 7-Loch-Pulvers ab. Das ist ein Pulver mit vornehmlich oder teilweise progressivem Abbrand. Der Durchmesser derPulverstange sollte dabei wenigstens das 10fache des Durchmessers eines Loches betragen.
Pulver mit progressivem Abbrand werden verwendet, wenn eine große Mündungsgeschwindigkeit des Geschosses (Abgangsgeschwindigkeit, V0) bei einem möglichst geringen Gasdruck erreicht werden soll.
Wie entsteht TNT?
Das vermutlich wegen seiner einprägsamen Abkürzung bekannteste Sprengmittel ist das Trinitrotoluol, kurz, das TNT, das wegen seiner guten Handhabbarkeit und Transportsicherheit überwiegend zu militärischen Zwecken verwendet wird. Das TNT wird unter vielen Namen gehandelt, z.B. trinitrotoluene, trinitroluéne, Trotyl, Trilite, Tolit, Tutol, Triton, Tri und Füllpulver 02. Der chemische Name Trinitrotoluol teilt uns mit, aus welchen Bestandteilen dieser Sprengstoff besteht, nämlich aus einem methylierten Benzol (der methylierte Benzolring heißt Toluol), das an drei Stellen seines Umfanges mit Salpetersäure nitriert wurde (daher Trinitro…).
Wegen dieser drei nitrierten Stellen am Toluol, den “Andockungen”, muß die Bezeichnung korrekt 2, 4, 6-Trinitrotoulol heißen. Damit ist gesagt, an welchen Positionen des Benzolringes die Salpetersäure HNO3 sozusagen Fuß gefaßt hat. Daraus folgert, daß es auch eine Fertigung von 1, 3, 5-Trinitrotoluol geben muß.
Der Ausgangspunkt zum TNT ist ein gesättigter Kohlenwasserstoff, das Kettenmolekül Hexan:
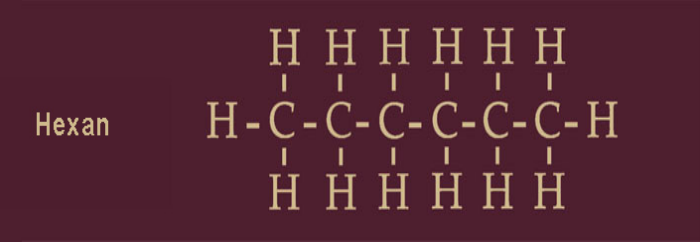
Das mag für den Laien ziemlich verwirrend aussehen. Wir haben in der Mitte des Kettenmoleküls Hexan sechsmal den Buchstaben C, der für das Kohlenstoffatom steht. Die Cs sind umrankt vom Buchstaben H, der das Wasserstoffatom bezeichnet. Rundherum ist kein Platz für einen weiteren Buchstaben -also für ein weiteres Atom- frei; das Molekül ist gesättigt. und weil dieses Molekül aus Kohlenstoff und Wasserstoff besteht, gehört Hexan zu den gesättigten Kohlenwasserstoffen. Zu seinem Namen kam das Hexan durch die griechische Sprache: Hexa bedeutet Sechs.
Die Reihe der gesättigten Kohlenwasserstoffe beginnt mit dem Methan und setzt sich dann mit Äthan, Propan, Butan, Pentan, dann Hexan, Heptan Octan, Nonan, Dekan usw. fort. Sie gehören zur Gruppe der Alkane. Die Häufigkeit des Kohlenstoffatoms C bestimmt den Platz des Moleküls in der Hierarchie der Alkane. Deshalb finden wir Hexan auf dem sechsten, Nonan (für 9) auf dem neunten und Methan mit nur einem C auf dem ersten Platz.
Kohlenstoffe sind in der modernen Chemie leicht zu verarbeiten. Durch Dehydrieren von 2H -die beiden rot eingezeichneten Wasserstoffatome- sind die Enden des Kettenmoleküls unbesetzt. Sie vereinigen sich zu einem geschlossenen Ring, dem Cyclohexan. Diese Cyclo-Alkane haben andere Strukturen und chemische Eigenschaften als die Ketten-Alkane. Das Dehydrieren erzeugt also Eigenschaften, die den Nutzungsbereich der Alkane erweitern. Cyclohexan ist ein Vertreter der karbozyklischen hydroaromatischen Verbindungen. Das sind farblose, wasserunlösliche, brennbare Stoffe, die im Erdöl vorkommen und das Ausgangsprodukt für weitere Stoffe bilden: Durch Addition von Chlor (Cl) entsteht z.B. Hexachlorcyclohexan (C6H6Cl6), ein Mittel zur Insektenbekämpfung.
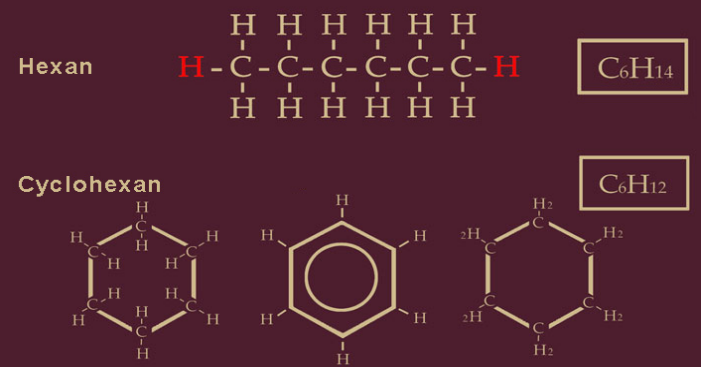
Cyclohexan wird zur Produktion von Kunstfasern wie Nylon verwendet und als Lösungsmittel eingesetzt. Es kommt natürlich im Erdöl vor. Etwa 40 Prozent des in den Chemiewerken produzierten Cyclohexans werden allein in Europa verbraucht, denn Europa ist der größte Abnehmer für diesen Kohlenwasserstoff. Die oben abgebildeten Schreibformen zeigen die Molekularstruktur zweidimensional, damit wir uns die Arbeitsschritte besser vorstellen können.
Der Ring im mittleren Symbol bezeichnet die Wasserstoffatome, die wegen der Übersichtlichkeit nicht wie im linken Symbol mitgezeichnet wurden. Mit der Bildung von Cyclohexan (von Zyklus = Ring) ist der erste Schritt zum Trinitrotoluol getan. Es wird nun zu einem Benzolring verarbeitet, indem es um sechs weitere Wasserstoffatome dehydriert wird. Die in das Kästchen eingetragene Bruttoformel zeigt, aus welchen und wievielen Atomen dieses Molekül besteht. Es sind jetzt vom Ausgangsprodukt C6H14, dem Kettenmolekül Hexan, noch 6 Kohlenstoffatome und 6 Wasserstoffatome übrig.
Das ist das Benzol, das nach einer anderen Übereinkunft auch Benzen heißt. Auf die vielen Schreibweisen des Benzolringes verzichten wir hier.
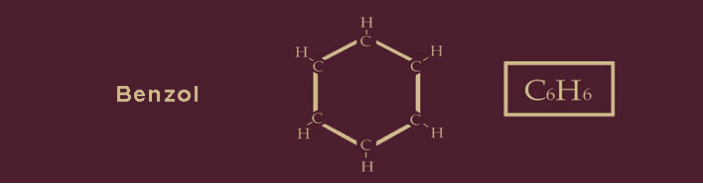
Den Namen Benzol erhielten wir vom arabischen Wort „luban dschawi“ („Weihrauch aus Java“). Es gelangte über die Handelswege nach Europa und wurde im Italienischen zu „benjui“ und im Mittellateinischen zu „Benzoé“ umgeformt. Wegen des typischen Geruchs gehört Benzol zu den Aromaten. Von unserem Ziel TNT sind wir immer noch ein gutes Stück entfernt. An den Benzolring wird nun eine Methylgruppe angedockt. Methyl ist ein williges Instrument der Chemie; es wird aus dem Methan gewonnen, dem ersten und einfachsten Alkan. Methyl ist ein funktionales Molekül, das aus einem Kohlenstoffatom und drei Wasserstoffatomen besteht: CH3.
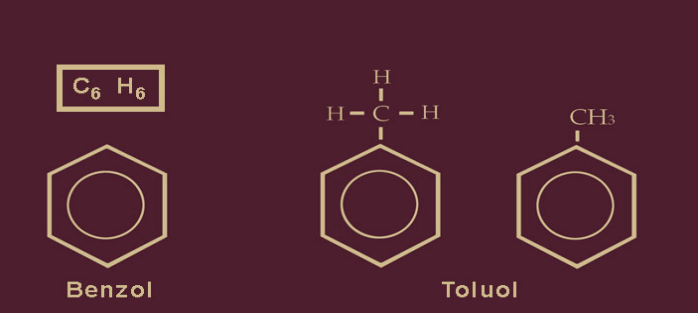
Wird dem Benzolring eine Methylgruppe “aufgesetzt”, dann ändert sich auch der Name des neuen Produkts. Die Bezeichnung Toluol hat sich durchgesetzt, das Methylbenzol ist weniger gebräuchlich. Die Namen der chemischen Produkte ändern sich aber -ebenso ihre zeichnerische Darstellung- mit den geraden oder ungeraden Jahreszahlen… Die einfachste Schreibweise finden wir im Bild rechts. Mit dem Toluol ist nun erstmals ein Produkt entstanden, das uns sehr nahe an das Trinitrotoluol heranführt. Zuerst muß das Toluol aber noch nitriert werden.
Zur Nitrierung des Toluols wird allgemein die Nitriersäure, ein Gemisch von konzentrierter Salpetersäure und konzentrierter Schwefelsäure, verwendet. Das Mengenverhältnis schwankt zwischen 1:2 und 2:1. Hier nur die Salpetersäure abgebildet:
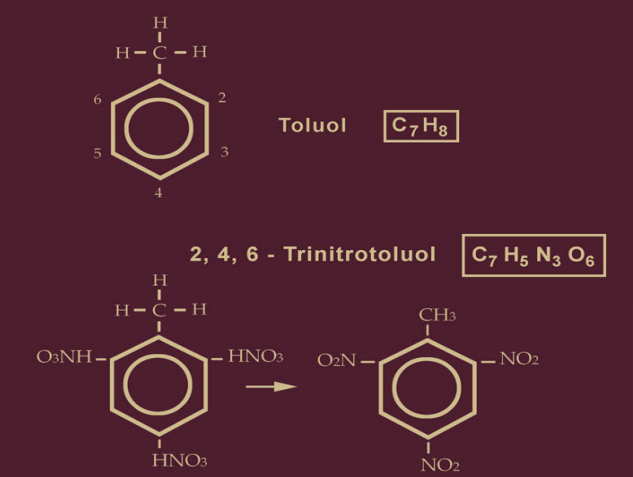
Zur übersichtlichen Darstellung befindet sich die Methylgruppe CH3 stets auf der oberen Spitze des Benzolringes, die als Bindungsstelle 1 festgelegt ist. Die Bruttoformel für das Toluol im Kästchen zeigt noch 8 Wasserstoffatome an, denn an den Positionen 2 bis 6 befinden sich die übriggebliebenen 5 Wasserstoffatome, an jeder Position je 1 H, und zu diesen 5 müssen die 3 Wasserstoffatome addiert werden, die sich an der Methylgruppe befinden. Die erste Andockstelle für die Salpetersäure HNO3 (die spätere NO2-Gruppe) ist demnach die Position 2, dann an der unteren Spitze die Position 4 und die dritte an der Position 6. Die Nitrierung des Toluols findet also in drei Stufen statt.
Aus der Salpetersäure HNO3 (linke Abbildung) ist in der rechten Abbildung die Nitriergruppe NO2 geworden. Wie war das möglich? Wir erinnern uns, daß sich an jeder der drei Andockstellen noch kurz zuvor das H des Toluols befand. Während des Andockens gibt das HNO3 ein O (Sauerstoff) und ein H (Wasserstoff) ab. Das Atom Sauerstoff O verfügt in seiner Außenschale über 2 Elektronen, und nur an dem einen befindet sich ein H. Für den immer reiselustigen Wasserstoff ist dies eine günstige Gelegenheit, das Toluol zu verlassen. Die Hs der Positionen 2, 4 und 6 wechseln zu den letzten freien Elektronen der Sauerstoffatome O über. Das O hat jetzt 2 Wasserstoffatome an sich gebunden und dadurch neue Eigenschaften und einen neuen Namen erworben; es heißt jetzt folgerichtig H2O – Wasser!
Physikalische Eigenschaften
Trinitrotoluol tritt in zwei Formen auf, die sich schon durch ihre Farbe unterscheiden. Die stabile Form bildet hellgelbe, nadelförmige Kristalle, die bei 80,4 °C schmelzen. Die zweite Form bildet orangefarbene Kristalle, die sich erst beim Erhitzen auf 70 °C in die erste Form umwandelt. In Wasser ist die Verbindung kaum löslich, nur teilweise in Methanol, gut löslich aber in Äther, Äthylacetat, Aceton, Benzol, Toluol und Pyridin. Wegen seines niedrigen
Schmelzpunktes (80,8 °C) schmilzt TNT in Wasserdampf und kann dann in Formen gegossen werden. Die Verbindung verträgt eine Dauererhitzung bis 140 °C, doch schon oberhalb 160 °C setzt eine Gasentwicklung ein. Ab 240 °C verpufft TNT unter starker Rußentwicklung. TNT ist giftig und kann bei Hautkontakt starke allergische Reaktionen hervorrufen. Es färbt Haut und Haar leuchtend gelborange.
Wichtiges zum Explosionsverhalten
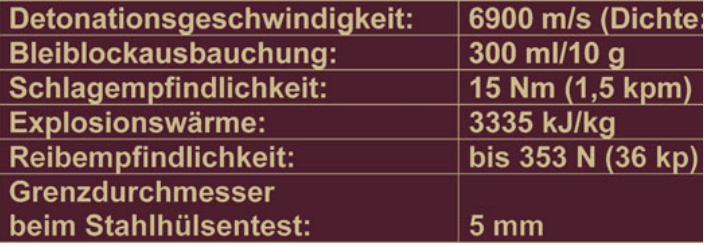
Vorsorglich bitte ich die Chemiker unter den Lesern um Vergebung für diese eher populär als wissenschaftlich gefaßte Darstellung. Sehen Sie bitte von gutgemeinten Hinweisen und Verbesserungen ab. Das Ziel ist nicht die Ausbildung zum Sprengstoffchemiker für den Hausgebrauch, sondern jenen verständlich zu sein, denen die Chemie der Kohlenwasserstoffe bisher kein tieferes Anliegen war.
Kontakt & Hilfe
Sie brauchen Hilfe bei der Bestellung? Kontaktieren Sie uns einfach per E-Mail. Wir melden uns schnellstmöglich bei Ihnen und helfen gerne.

Schreiben sie eine e-mail
4vverlag@kriegsfeuerwerkerei.de